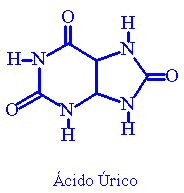
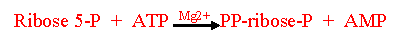Ácido úrico
31 de maio de 2013 | Autor: antonini
Base fisiológica
É o principal metabólico das purinas ingeridas pelo homem, e forma-se a
partir da xantina por oxidação pela enzima xantina-oxidase. É um ácido
fraco, com pKa em torno de 10,3. Existe nos tecidos sob a forma de
uratos que são filtrados nos glomérulos e a urina consegue dissolver
aproximadamente o dobro da quantidade solúvel em água. O ácido úrico
(uratos) se eleva muito em tratamentos por drogas quimioterápicas em
pacientes em preparo para transplante de medula óssea, ou em caso de
carcinomas. É excretado pelos rins.
Doenças associadas ao ácido úrico
Gota
Moléstia metabólica genericamente transmitida , é caracterizada por um
aumento na concentração de ácido úrico no soro ou no plasma, aumentando
no total de ácido úrico no organismo e deposição nos tecidos. O aumento
da concentração de ácido úrico no soro ou plasma pode acompanhar um
aumento do catabolismo de nucleoproteína.
É o principal metabólico das purinas ingeridas pelo homem, e forma-se a
partir da xantina por oxidação pela enzima xantina-oxidase. É um ácido
fraco, com pKa em torno de 10,3. Existe nos tecidos sob a forma de
uratos que são filtrados nos glomérulos e a urina consegue dissolver
aproximadamente o dobro da quantidade solúvel em água. No hospital
geral, a solicitação de exame de ácido úrico é feita em maior número
pelas unidades de Quimioterapia de Alto Risco e Transplante de Medula
Óssea, tanto a ambulatorial (quarto andar do anexo B), quanto a unidade
de internação (décimo quinto andar do Hospital), visto que o ácido úrico
(uratos) se eleva muito em tratamentos por drogas quimioterápicas.
O doseamento do ácido úrico no sangue é feito pela leitura
espectrofotométrica da cor do produto da seguinte reação:
O exame de ácido úrico, além de servir de controle nos tratamentos por
quimioterapia, também é necessário para diagnóstico da gota, visto que
esse metabólito se deposita nas articulações provocando edema,
inflamação e até lesão articular, mas a pior conseqüência da
hiperuricemia são as lesões de retina, pois o ácido úrico ataca os
receptores deste tecido podendo até levar à cegueira irreversível.
A determinação dos níveis de ácido úrico tem importância em alguns
distúrbios metabólicos das purinas, com especial atenção para a gota.
Estas desordens produzidas por várias causas, tem como dado fundamental
um aumento do “pool” do ácido úrico, traduzido na maioria das vezes por
um nível sérico de ácido úrico, ou seja, hiperuricemia.
É necessário frisar-se de antemão a diferença importante entre um estado
hiperuricêmico e a doença chamada gota.
Podemos assim encontrar hiperuricemia em várias situações, sem que
tenhamos manifestações clínicas ou anátamo-patológicas desta
anormalidade. Quando em decorrência da hiperuricemia, temos
precipitações de cristais de monourato de sódio em membrana sinovial,
cartilagem articular, celular subcutâneo ou rins, temos configurada a
entidade nosológica gota ou artropatia úrica.
Conhecemos, assim, vários fatores que podem provocar uma hiperuricemia
não gotosa:
- Psicossociais e sociológicos
- Hábitos alimentares
- Inatividade física
- Obesidade
- Doenças {que provocam lise celular)
- Insuficiência renal
- Medicamentos
Com relação à doença gota, didaticamente, podemos
separá-la em:
A primária, a mais comum, é a aquela de causa
desconhecida e ligada a fatores genéticos.
A secundária, ao contrário, desenvolve-se como explicação de alguma
doença (síndromes mieloproliferativas, intoxicação saturnínica,
insuficiência renal, poliglobulia, etc.) ou em decorrência da ação de
certos medicamentos, por exemplo, diuréticos.
Muitas vezes é difícil separar-se uma gota primária de uma secundária,
como também é interessante lembrar.
O ácido úrico do plasma é filtrado pelos glomérulos e reabsorvido, em
seguida, pelos túbulos em proporção aproximada de 90%. Representa no
homem o produto final do metabolismo das purinas. O teor de ácido úrico
no plasma é muito influenciado por fatores extra-renais, além dos
renais.
Metabolismo da Purina e da Pirimidina no Ser Humano
As purinas e as pirimidinas são bases cíclicas complexas que, como seus
respectivos nucleotídeos, constituem a estrutura química das informações
genéticas e da transcrição e tradução dessas informações em estrutura
protéica nas células vivas. Como constituinte de ATP, GTP, UTP, NAD, FAD
e outras moléculas, também recebem e transferem seletivamente a energia
para finalidades metabólicas. Como AMP e GMP cíclicos, funcionam como
importantes sistemas reguladores, muitas vezes como o sinal final da
ação hormonal. Em certo sentido, todos os distúrbios genéticos são
distúrbios do “metabolismo” das purinas e pirimidinas enquanto expressos
na seqüência linear de informações expressas através do código triplo.
Nesta seção, entretanto, esse termo será usado em seu sentido mais
restrito, aplicado às anormalidades que foram demonstradas na síntese ou
degradação das purinas ou pirimidinas em si ou de seus respectivos
nuclosídios ou nucleotídios.
Metabolismo das Purinas
As bases da purina de importânica no metabolismo humano estão ilustradas
na figura 1, com uma indicação das fontes fundamentais dos átomos
constituintes. Há utilização limitada de purinas da dieta pré-formadas e
reutilização considerável, embora ainda não quantificada, de bases de
purina liberadas durante o catabolismo por um processo conhecido como
“síntese de salvamento” dos nucleotídios de purina. Entretanto, a
maioria das purinas é produzida por uma neo-síntese, a uma velocidade de
aproximadamente 4 mmol por dia num adulto de estatura mediana. Em
equilíbrio, uma quantidade semelhante é metabolizada em uma forma
não-utilizável, em grande parte ácido úrico (0,7 g), da qual dois terços
a três quartos são excretados na urina. O ácido úrico restante é
secretado para o trato gastrintestinal para ser ali destruído por
metabolismo bacteriano.
Catabolismo das Purinas
O produto final do catabolismo de purinas no ser humano é o ácido úrico,
que é totalmente sintetizado pelas oxidações seqüenciais da hipoxantina
e da xantina catalisadas pela xantina oxidase (conforme figura 2). A
hipoxantina é produzida diretamente a partir da inosina e da
desoxiinosina pela ação da purina nucleosídio fosforilase e, mas
remotamente, a partir da adenosina e da desoxiinosina catalisadas pela
adenosina desaminase. A guanina, como base livre, deriva da guanosina ou
da desoxiguanosina, mais uma vez cataisadas pela purina nucleosídio
fosforilase e depois ixidativamente desaminada em xantina catalisada por
guanase. Essas vias são pertinentes tanto para as fontes exógenas
(dietéticas) de purinas quanto para as fontes endógenas. A xantina
oxidase é encontrada em sua maior concentração no fígado e nos
intestinos, mas também exibe atividade vestigial nos rins, no baço e nos
músculos.
Destino do ácido úrico
O ácido úrico é produto final do metabolismo de purina no ser humano (e
certos outros primatas, pássaros e répteis) ao contrário de outros
mamíferos que hidrolisam urato relativamente insolúvel em alantoína
altamente solúvel com a enzima uricase. O tamanho do pool do urato
extracelular varia conforme o sexo e a estatura, sendo maior no homem,
mas geralmente se situa numa gama de 600 a 1200 mg. Aproximadamente dois
terços desse pool se renovam diariamente num estado de equilíbrio
estável, isto é, excretado e substituído por nova formação de urato. A
figura 3 ilustra os níveis séricos normais de urato nos homens e
mulheres, de acordo com a idade. É provável que não mais de 5% de urato
se combine com as proteínas plasmáticas (albumina e uma globulina de
ligação com a1- a2-urato) in vivo. A um pH de 7,40 o urato existe em
grande parte em sua forma de sal de sódio.
O urato é excretado tanto pelos rins (dois terços a três quartos) quanto
pelo trato intestinal enquanto constituinte da saliva, do suco gástrico,
do suco pancreático, do suco entérico e da bile. O urato que entra nos
intestinos é destruído pelas enzimas bacterianas. Se forem usados
antibióticos para produzir bacteriostase, o urato livre pode ser
recuperado nas fezes. Não se dispões de muitas informações sobre as
variáveis da excreção intestinal do urato, inclusive sobre possíveis
efeitos dos agentes farmacêuticos. Os agentes que intensificariam a
excreção relativa do urato pelo intestino seriam de importância
terapêutica evidente na inversão da hiperuricemia sem os perigos da
passagem do urato através dos rins. Até hoje não se conhecem esses
agentes.
A excreção do urato pelo rim humano é complexa e não pode ser
considerada aqui com detalhes. Todo (ou quase todo: >95%) o urato
plasmático é filtrado pelo glomérulo. A reabosorção tubular ativa do
urato ocorre no túbulo proximal em ligação estreita com a de outros
componentes do filtrado, especilamente o sódio. Simultaneamente há
secreção tubular líquida do urato, seguida ainda por reabsorção
pós-secretória (Figura 4). O resultado final desse intrincado processo
de filtração e reabsorção e secreção combinadas é um “clearance” de
aproximadamente 6 a 8% do da insulina.
Distúrbios do Metabolismo da Purina
Há alguns distúrbios do metabolismo da purina que ocorrem
espontaneamente no ser humano, seja como defeito genético ou como
anormalidades adquiridas. Os distúrbios que aqui serão sucintamente
estudados estão arrolados na tabela 1. Daremos maior atenção à patogenia
desses distúrbios na medida da disponibilidade de explicações
decorrentes do conhecimento atual sobre o metabolismo normal da purina.
TABELA 1 – Distúrbios do Metabolismo das Purinas
__________________________________________________________________
Gota:
- metabólica (superprodução) primária e secundária.
- renal (subexcreção) primária e secundária
- Deficiência de hipoxantina-guanina fosforribosiltransferase
- (Síndrome de Lesch-Nyhan e variantes)
- Deficiência de adenina fosforribosiltransferase
- Distúrbios purinogênicos da função imune
- deficiência de adenosina desaminase
- deficiência de purina nucleosídio fosforilase
- Deficiência de mioadenilato desaminase
- Excesso de adenosina desaminase
- Xantinúria
- Deficiências de folato e vitamina B12
- Diátese de cálculos de ácido úrico
__________________________________________________________________
A gota é sem dúvida o distúrbio mais importante do metabolismo das
purinas no ser humano. Pode ser definida como um grupo de distúrbios do
metabolismo das purinas que produz hiperuricemia contínua. Quando
clinicamente manifesta, está associada a uma ou mais das seguintes
características:
– artrite aguda e inflamatória:
- deposição de urato de sódio em vários tecidos, na forma de tofos;
- cálculos renais de ácido úrico;
- insuficiência renal.
A fisiopatologia da gota pode ser discutida com
base na resposta a duas perguntas:
- O que causa as manifestações específicas desse complexo de
doenças?
- O que causa a hiperuricemia, que é a principal característica da
gota?
Manifestações da Gota
Todas as manifestações da gota podem ser atribuídas ao acúmulo ou à
concentração excessiva de urato no organismo. Não há provas de que o
urato em solução seja lesivo ao hospedeiro. Portanto, todas as
caraterísticas clínicas da gota resultam direta ou indiretamente da
cristalização do sal sódico de urato no organismo ou de ácido úrico
livre na urina. A um pH de 7,40 e a 7,37ºC, a saturação do plasma humano
pelo urato ocorre a aproximadamente 7,0 mg/dl. É evidente que muitos
pacientes com gota ou hiperuricemia assintomática são cronicamente
“supersaturados”. A solubilidade do ácido úrico na urina depende muito
do pH. A um pH 5 o nível de saturação é de aproximadamente 15mg/dl; a um
pH 7 a solubilidade pode ser mais do que dez vezes maior (160 a 200
mg/dl).
Artrite gotosa aguda
A artrite gotosa aguda tem um início tipicamente rápido, vem associada a
acentuados sinais de inflamação na articulação afetada e em torno dela,
é extremamente dolorida. Um ataque geralmente sucede a um evento de
estresse e o local de comprometimento inicial mais freqüente é a
primeira articulação matetarsofalângica, numa condição conhecida desde
os tempos de Hipócrates como “podagra”. O exame do líquido sinovial
retirado da artrite gotosa aguda quase sempre revela finos cristais
negativamente birrefringentes de urato sódico, alguns dos quais
fagocitados por leucócitos polimorfonucleares (Figura 5). Esse achado é
tão constante que tem valor diagnóstico.
Parece ser necessária uma interação do cristal e dos leucócitos para a
patogenia da gota aguda, que é uma forma especial daquilo que se chamou
sinovite microcristalina (Figura 6). Os leucócitos fagocitam os cristais
de urato sódico e liberam um fator quimiotático que atrai outros
leucócitos para a área de inflamação. A principal ação da colchicina,
medicamento amplamente usado no tratamento da gota pode ser bloquear a
liberação desse fator. Dentro do leucócito, forma-se um fagolisosoma em
torno do cristal, como tentativa de digeri-lo. Infelizmente as forças
superficiais do cristal rígido reagem por pontes de hidrogênio com a
membrana fosfolipídica do fagolisosoma, rompendo sua continuidade para
liberar enzimas líticas no citoplasma do leucócito. Em suma, o leucócito
ataca o cristal de modo apropriado para uma bactéria, mas inapropriado
para um cristal inanimado. Nesse processo sua organela digestiva é
rompida, provocando a autólise e a liberação de seu conteúdo e do
cristal inalterado de volta oara a área da inflamação. Além de seu papel
na ruptura de leucócito, o cristal de urato de sódio pode ativar o fator
de Hageman e assim pôr em movimento uma cascata de eventos que reforça a
inflamação através da ativação da calicreína e da liberação das cinicas.
Resulta a vasodilatação, a intensificação da permeabilidade capilar e
marginação e quimiotaxia dos leucócitos. Os cristais de urato também
podem ativar o sistema de complemento pela ativação de C1 quando
incubados com o precursor da macromolécula intacta C1 qrs. Ainda não
está determinado se a ativação do complemento desemenha algum papel na
artrite gotosa espontânea.
Por que a atrite gotosa se manifesta tantas vezes como podagra? A
resposta não é conhecida. A solubilidade do urato de sódio depende muito
da temperatura ea primeira articulação metatarsofalângica é distal e
relativamente fria. Essa articulação também está sujeita a pressões
consideráveis durante anos, suportando peso e andando. Na reabsorção das
efusões articulares, a água é mais rapidamente reabsorvida do que o
urato. Isso tende a concentrar o urato, provocando a saturação.
Postulou-se que as microefusões ocorrem secundariamente à doença
degenerativa articular e que no processo de reabsorção o urato se
concentra numa articulação distal fria, provocando a podagra. Essa
afirmação seria congruente com o fato de que, embora a hiperuricemia
geralmente apareça na puberdade no paciente gotoso, o primeiro ataque de
artrite ocorre cerca de 25 a 30 anos mais tarde, possivelmente quando já
tenha surgido a doença articular degenerativa. As anormalidade do
metabolismo das proteoglicanas foram também aventadas na gênese da gota
aguda, já que esses polissacarídeos protéicos complexos do tecido
conjuntivo mostram capacidade de intensificar a solubilidade do urato em
estudos in vitro.
Por que o ataque de artrite gotosa aguda é autolimitado? Mesmo sem
tratamento a inflamação geralmente regride em poucos dias. Os mecanismos
para a recuperação espontânea não foram elucidados. A própria inflamação
pode aumentar a solubilidade pelo calor e pela remoção do urato através
do fluxo sangüíneo maior. Os leucócitos contêm mieloperoxidase que é
capaz de metabolizar algum urato, embora a importância disso não tenha
sido determinada. A secreção de glicocorticóides induzida pela pressão
pode reduzir a inflamação. Provavelmente há outros processos de
limitação e reparação que ainda não estão claros.
Em resumo, a artrite gotosa resulta de sinovite induzida por cristais e
exige a interação de microcristais de urato sódico com leucócitos
polimorfonucleares. A ativação do fator de Hageman e da cascata do
complemento pode desempenhar papéis coadjuvantes. Os fatores que induzem
a inoculação de uma articulação com cristais em determinado período, em
face de uma hiperuricemia prolongada, não estão claros, assim como os
fatores que induzem a recuperação espontânea. O modelo cristal-leucócito
da gota aguda é um avanço importante no conhecimento sobre a patogênese
deste distúrbio e de outros semelhantes.
Gota tofosa
A deposição dos cristais de monoidrato de urato de sódio, geralmente no
tecido conjuntivo, resulta em tofos, uma das manifestações mais
surpreendentes da gota (Figura 7). Essas massas de cristais induzem uma
reação inflamatória mononuclear com granulomas e fibroses de corpos
estranhos. Os tofos ocorrem na maioria das vezes nas cartilagens, nas
bainhas subcutâneas da pele, nas bursas e nos rins. Podem ocorrer em
praticamente qualquer tecido do corpo, exceto no sistema nervoso
central, onde a concentração de urato é reduzida (< 1,0 mg/dl no
fluido cerebroespinhal) pela barreira hematoencefálica. Os tofos são
também muito raros no fígado, no baço e nos músculos esqueléticos.
Pouco se sabe sobre a fisiopatologia dos tofos. Obviamente representam
uma doença de armazenamento, a cristlização de urato sódico a partir do
fluido extracelular supersaturado. A razão pela qual essa cristalização
ocorre com maior probabilidade na cartilagem do que nos músculos
esqueléticos, por exemplo, não está clara. Alguns pacientes podem ser
acometidos por tofos maciços, enquanto outros, com concentrações
semelhantes de urato de sódio, podem ser assintomáticos ou ter apenas
ataques raros de artrite gotosa aguda. Não foram convincentes as
tentativas de explicar as diferenças na suscetibilidade aos tofos com
base nas diferenças das ligações ptotéicas do urato no plasma. Os tofos
podem ser remobilizados por medidas que reduzem as concentrações de
urato sérico abaixo do nível de saturação durante períodos prolongados.
Formação de cálculos de ácido úrico
Os cálculos de ácido úrico formam-se com maior freqüência nos indivíduos
gotosos do que nos não-gotosos. Por outro lado, a maioria dos cálculos
de ácido úrico ocorre em pacientes sem gota. Essa manifestação da gota
será discutida adiante, quando tratarmos da diástese do cálculo de ácido
úrico
Insuficiência renal
A insuficiência renal às vezes ocorre com complicação da gota. A
patogenia da insuficiência renal pode ser complexa, mas o fator mais
importante é provavelmente a deposição intersticial de cristais de
monoidrato de urato sódico, especialmente nas áreas medulares dos rins.
O resultado é a inflamação crônica e a fibrose, que causa uma nefrite
intersticial muitras vezes erroneamente tomada por pielonefrite crônica,
no passado. Outras características do rim gotoso podem compreender a
formação de cálculos de ácido úrico com obstrução e pielonefrite
secundária, nefrosclerose e possivelmente uma lesão glomerular inicial.
A insuficiência renal aguda pode resultar de precipitação maciça de
ácido úrico nos túbulos coletores, geralmente em associação com
quimioterapia de doenças malignas com liberação súbita de purinas, o que
resulta em sobrecarga de urato no pulso.
Causa da Hiperucemia
Todas as manifestações de gota resultam da cristalização de urato sódico
ou ácido úrico a partir de soluções supersaturadas. A patogenia das
síndromes gotosas é, em última instância, a da hiperuricemia e/ou
hiperuricosúria.
Um aumento na concentração de um metabólito no corpo pode ser causado
por quatro variáveis que podem agir independentemente ou em conjunto:
(1) aumento na formação; (2) redução do metabolismo; (3) redução da
excreção; (4) aumento da absorção (a partir de fontes exógenas). O urato
não é metabolizado em grau significativo pelos tecidos humanos por causa
da ausência de uricase. É metabolizado pelas bactérias após sua secreção
para o intestino, talvez com um quarto a um terço sendo assim
metabolizado. Não há provas de que essa via de metabolismo por secreção
seja prejudicada na gota. De fato, provavelmente ela constitua uma
válvula segura para o controle do urato quando sobrevém a insuficiência
renal. Na dieta normal há muito pouco urato pré-formado e do urato que
se acrescenta (urato com C14) apenas 10% pode ser recuperado inalterado
na urina. Aproximadamente 25% das purinas de DNA ingeridas e 50% das
purinas de RNA aparecem em última instância como urato urinário através
de vias degradativas que já descrevemos. embora o nível sérico de ácido
úrico possa elevar-se um pouco pelo excesso de ingestão de purina, não
há provas de que os pacientes com gota absorvem purinas dietéticas com
maior avidez, e de que aí esteja a patogenia da hiperuricemia. A
hiperuricemia prolongada no ser humano, portanto, resulta apenas de uma
excessiva neo-síntese de purinas, reduzida eficiência de excreção renal
de urato, ou ambos os fatores atuando em conjunto.
Em certo sentido, todos os seres humanos correm o risco de gota. Os
homens adultos normais têm uma média de ácido úrico sérico de 5,0 mg/dl
(mais de 70% saturado) e as mulheres cerca de 4,3 mg/dl (mais de 60%
saturado). Com certeza poderia parecer uma uricemia inapropriada cem
nenhuma vantagem biológica. Essa condição de risco da purina é
secundária a dois eventos: (1) a perda de uricase, que teria convertido
o urato em alantoína; e (2) a reabsorção inapropriada de urato a partir
do filtrado glomerular pelo túbulo proximal renal. Há alguns casos raros
em que a incapacidade de reabsorção de urato pelos túbulos renais ocorre
como uma deficiência isolada. Essas pessoas têm “clearances” de urato
maiores que os de creatinina, têm hipouricemia (muitas vezes <1,0
mg/dl) e uma saúde excelente.
Gota metabólica (de superprodução)
Essa forma de gota resulta da síntese excessiva e contínua de
nucleotídios de purina a partir de precursores simples através de uma
nova via, conforme descrevemos acima e em equilíbrio, uma oxidação
irreversível correspondente de bases de purina em ácido úrico. Há três
métodos gerais para calcular a taxa de produção de ácido úrico:
- Medir a excreção de ácido úrico de 24 horas na urina, com uma
dieta pobre em purinas. Como uma quantidade significativa, mas
variável, de ácido úrico é destruída pela urinólise no intestino, o
médico simples demonstra superprodução somente quando o urato
urinário está notavelmente com uma dieta pobre em purinas (>
aproximadamente 600 mg/dia) ou numa dieta normal (> 800 mg por
dia). Alguns pacientes com excreções normais ou anormais altas
realmente serão “superprodutores”, mascarados por um grande desvio
de ácido úrico para o intestino.
- Medir as dimensões do pool e da taxa de reposição de urato no
líquido extracelular. Essa é uma técnica de pesquisa que exige o uso
de ácido úrico marcado (C14 ou N15) para determinar a dimensão do
pool por diluição de isótopo. A partir da diluição progressiva do
urato isotópico com o composto não-marcado neoformado sobre o tempo,
pode-se calcular a taxa de turnover do pool miscível e, a partir
desses valores, a taxa sintética. Essa técnica não pode ser usada
para estudar pacientes com tofos, pois a troca desigual do isótopo
com urato da fase sólida introduz um erro significativo na medição
da dimensão do pool.
- Medir a taxa de incorporação dos precursores marcados da purina no
ácido úrico. Os precursores mais freqüentemente usados são a glicina
ou a aminoimidazol-carboxamida.
Esses métodos forma aplicados no estudo de pacientes com gota e
descobriu-se que aproximadamente 10 a 15% (a porcentagem varia nos
diferentes laboratórios) tinham superprodução de purinas como causa da
hiperuricemia.
A superprodução pode ser primária (genética) ou secundária a lagum outro
processo mórbido associado com intensificação da síntese e do
catabolismo dos tecidos e, portanto, de seus ácidos nucléicos
componentes. Os exemplos dessa doenças compreendem a metaplasia
agnogênica mielóide e a psoríase. A hiperuricemia primária de
superprodução, entretanto, não está associada a qualquer indício maior
de formação e destruição tecidual. Possivelmente resulta de deficiências
herdadas no metabolismo da purina que, direta ou indiretamente,
intensifica a neo-síntese. Algumas dessas deficiências foram elucidadas,
mas a maioria não. Os distúrios arrolados na Tabela 2 atualmente
representam por menos de 5% dos pacientes com gota metabólica primária.
A deficiência de hipoxantina-guanina fosforribostiltrasferase, muito
embora seja uma forma de gota metabólica, tem características
suficientemente distintivas para justificar sua discussão posterior,
como uma entidade autônoma. As outras anormalidades enzimáticas,
associadas a essa forma de gota serão apresentadas suscintamente.
TABELA 2 – Classificação da Patogenia da Hiperuricemia e da Gota
_________________________________________________________________
1. Metabólica – síntese excessiva e contínua de purinas
a. primária – causada por uma deficiência genética (todas essas
deficiências
até agora encontradas respondem por < 5% desses pacientes)
- deficiência de hipoxantina-guanina fosforribosiltransferase
- variantes da P-ribose P sintetase
3. deficiências de glicose-6-fosfatase
b. secundária – causada por maior “turnover” tecidual: metaplasia
mielóide agnogênica, psoríase, leucemia, etc.
2. Renal- eficiência reduzida contínua de excreção pelos rins.
a. primária – não foram elucidadas as anormalidades genéticas a nível
químico ou biofísico.
b. secundária – causada por doença renal ou pelo efeito de metabólitos
ou medicamentos sobre a excreção renal de urato.
- doença renal – a maior parte das formas de insuficiência renal,
nefropatia do chumbo.
- metabólitos – lactato, b-hidroxibutirato.
- medicamentos – pirazinamida, tiazidas, salicilatos, etc.
__________________________________________________________________
Teoricamente, a neo-síntese excessiva de purinas deve resultar de uma ou
mais dentre quatro anormalidades no primeiro passo, o da produção da
fosforribosilamina catalisada pela amidofosforribosiltransferase:
Essas anormalidades poderiam incluir (1) grande concentrações de
substrato, PP-ribose-P ou glutamina; (2) grande atividade intrínseca ou
reduzida sensibilidade a regulação por retroalimentação; (3) mudança na
concentração de uma molécula reguladora, que afeta a atividade
enzimática ou por competição com o substrato por sítios aticos ou por
alterações alostéricas na conformação; e (4) grande quantidade de enzima
transferase.
A PP-ribose-P funciona tanto como substrato da transferase quanto como
ativador alostérico. A PP-ribose-P sintetase, enzima codificada no
cromossoma X, catalisa sua formação conforme observado:
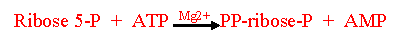
Descobriu-se que a atividade dessa sintetase em condições fisiológicas
aumenta nos homens com gota em diversas famílias, provocando a
superprodução de PP-ribose-P e, possivelmente, intensificando a síntese
de purina. É interessante notar que esses induvíduos exibem
anormalidades diversas distintas na enzima: elevação da Vmáx, maior
afinidade por ribose 5-fosfato e afinidades reduzidas por reguladores de
nucleotídeos de purina, respectiva-mente. Especulou-se que a excessiva
produção de purina encontrada na doença de armazenamento de glicogênio
(doença de von Gierke, tipo I) se deve em parte à maior disponibilidade
de ribose-5-fosfato por causa do desvio dessa via, secundário à
deficiência de glicose-6-fosfatase. entretanto, não foi demonstrado um
aumento nas concentrações teciduais de PP-ribose-P na doença de von
Gierke.
A glutamina também é um substrato na síntese de fosforribosilamina. Um
aumento na sua concentração intracelular também poderia ser uma força
impulsionadora para a superprodução de purina. Apesar das muitas
especulações, não ficou demonstrada com certeza nenhuma anormalidade
genética ou adquirida no metabolismo da glutamina, com base bioquímica
para a gota. De forma semelhante ainda não foram demonstradas
anormalidades intrínsecas da enzima amidofosforribosiltransferase nos
indivíduos com gota, embora esse pudesse ser um sítio lógico para a
ocorrência de deficiências, comparável aos descritos para a PP-ribose-P
sintetase.
Gota renal (subexcreção)
A maioria das gotas (85 a 90%) resulta de uma diminição na eficiência da
capacidade renal de excretar urato plasmático. Em equilíbrio, é
excretada uma quantidade normal de urato por unidade de tempo, mas à
custa de maior concentração plasmática. Como no caso da gota metabólica,
a gota renal pode ser primária (genética) ou secundária. Conforme
descrito anteriormente o “clearance” renal do urato é uma função
complexa de filtração glomerular e de reabsorção e secreção sobrepostas,
exercida pelo túbulo renal. por exclusão, supõe-se que os pacientes
gotosos sem superprodução de urato tenham subexcreção (na realidade
trata-se de uma redução na eficiência da excreção). Certo número de
estudos sobre o “clearance” demonstraram um “clearance” final reduzido
de urato nos pacientes gotosos, especialmente se comparados com os
indivíduos de controle que se tornaram hiperuricêmicos por manipulações
dietéticas.
A gota renal secundária resulta de qualquer doença renal crônica que
redunde em déficit funcional generalizado. Como todo (ou quase todo) o
urato filtrado pelo glomérulo é normalmente reabsorvido, a hiperuricemia
da uremia possivelmente represente uma capacidade secretória tubular
reduzida de filtração glomerular. Sabe-se que vários ácido orgânicos
naturais inibem a secreção tubular renal de urato, especialmente o
lactato e o b-hidroxibutirato, sendo portanto capazes de induzir a
hiperuricemia. Certo número de agentes farmacêuticos também inibem a
secreção tubular notadamente os salicilatos, a pirazinamida e o
etambutol. O metabolismo do etanol causa a hiperuricemia em parte por
elevar o lactato plasmático na forma de oxidação e redução conjugadas
entre a álcool desidrogenase e a desidrogenase láctica. Também aumenta a
síntese do urato. A ocorrência comum de hiperuricemia durante o uso de
agentes diuréticos poderosos (a tiazida é o mais estudado) com maior
probabilidade é resultado de grande reabsorção tubular conjugada com a
reabsorção tubular proximal de sódio durante o estado de contração de
volume. A nefropatia do chumbo é a provável causa de alta incidência de
gota associada ao plumbismo.
A gota renal primária ocorre em algumas famílias com reduzida eficiência
de excreção de urato, na ausência de qualquer outro indício de doença
renal intrínseca ou de qualquer concentração maior de metabólitos ou na
ausência de um medicamento que pudesse inibir a função tubular. Supõe-se
que tais pacientes tenham um problema hereditário na secreção tubular do
urato, mas é difícil excluir a reabsorção pós-secretória. A elucidação
da base bioquímica para essa anormalidade aguarda melhor definição do
mecanismo de secreção e absorção normal de urato. É possível que tais
pacientes tenham alguma outra deficiência genética que leve ao acúmulo
de um metabólito que, secundariamente, inie a secreção tubular de urato
(um efeito semelhante ao do lactato). Ainda não foi descoberto nenhum
desses metabólitos nesses pacientes com gota renal hereditária.
Princípios reacionais
Doseamento
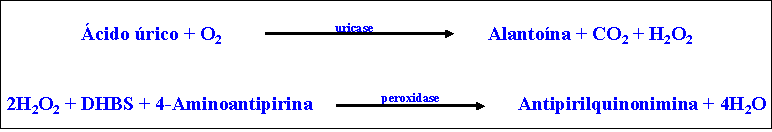
O doseamento do ácido úrico no sangue é feito pela leitura
espectrofotométrica da cor do produto da seguinte reação:
A intensidade do cor vermelha formada é diretamente proporcional à
concentração de ácido úrico presente na amostra em análise.
Métodos Colorimétricos
Os métodos colorimétricos derivam do método de Folim e Denis: redução,
pelo ácido úrico, de uma solução alcalina de fosfotungstato em óxido de
tungstênio, que dá uma coloração azul.
A dosagem é feita em soro de plasma porque, com o sangue total, a
hemólise liberaria substâncias redutoras que majorariam artificialmente
a uricemia. A dosagem é efetuada após desprotunização do soro, que pode
ser realizada de diversas maneiras: aquecimento em meio acético, ácido
fosfotúngstico, ácido tricloroacético e, sobretudo, diálise.
Entretanto, a uricemia determinada por métodos colorimétricos nem sempre
é exata: presença eventual, no plasma, de substâncias cromogênicas nos
uráticos (fenóis, ácido ascórbico, glicose, tirosina, triptofano,
cisteína, etc.). Essas causas de erro são negligíveis, salvo no caso de
utilização terapêutica dessas substâncias e, talvez, durante as
insuficiências renais.
Os métodos colorimétricos são os mais utilizados na prática, tanto mais
que são aplicáveis ao auto-analisador Technicon.
Amostra
Pode empregar-se soro ou plama. Deve evitar-se o EDTA e o fluoreto como
anticoagulante e conservante respectivamente, já que interferem na forma
positiva do método. O ácido úrico é estável durante 3 – 5 dias a 2 – 6ºC
e por 6 meses a -20ºC.
Também são úteis as alíquotas de urina de 24 horas. Para evitar
precipitação dos uratos adicionar 100 ml de hidróxido de sódio. O ácido
úrico é estável na urina or 3 dias a temperatura ambiente sempre que não
houver degradação bacteriana.
Interferentes
Devido à presença de substâncias interferentes nos glóbulos vermelhos,
as determinações de ácido úrico devem ser realizadas em soros sem o
menor traço de hemólise.
Após exercícios violentos e prolongados, ocorre um aumento na
concentração de ácido úrico no soro. Entre as substâncias capazes de
reduzir o ácido fosfotúngstico estão: o glutation, os fenóis, o ácido
ascórbico, a tirosina, o triptofano, a cistina e a cisteína.
A colchicina, o alopurinol, o probenecide e a sulfinpirazona reduzem a
taxa de ácido úrico no sangue, aumentando sua excreção ou bloqueando a
formação deste ácido a partir da xantina, pela inibição da xantina
oxidase.
Drogas que provocam efeitos fisiológicos: esteróides adrenocorticais
busulfam, ácido etacrínico, mostardas nitrogenadas, tiazidas,
antimetabólitos análogos da purina, pirazinamida, sulfato de
vencrestina, ácido acetilsalicílico, alopurinol, clorpromazina,
clorprotixeno, oxifeneritazona, fenilbutazona, probenecide.
Interpretação
Elevado
Na gota, pré-eclampsia e eclampsia, leucemia, policetemia, terapia com
drogas anti-leucêmicas e uma variedade de outros agentes; insuficiência
renal, doença de armazenamento de glicogênio (tipo I), síndrome de
Lesch-Nyhan (deficiência de hipoxantina-guanina-fosforibosil transferase
ligada ao cromossoma X) e síndrome de Down. A incidência de
hiperuricemia é maior em nativos das Filipinas do que em qualquer outros
brancos.
Diminuída
Na hepatite aguda (ocasionalmente) no tratamento com alopurinol ou com
probenecide.
O exame de ácido úrico, além de servir de controle nos tratamentos por
quimioterapia, também é necessário para diagnóstico da gota, visto que
esse metabólito se deposita nas articulações provocando edema,
inflamação e até lesão articular, mas a pior conseqüência da
hiperuricemia são as lesões de retina, pois o ácido úrico ataca os
receptores deste tecido podendo até levar à cegueira irreversível.
Valores de Referência
- No homem: 3 – 9 mg% (0,18 – 0,53mmol/l)
- Na mulher: 2,5 – 7,5 mg% (0,15 – 0,45 mmol/l)
O ácido úrico tem dois pKa, um de 5,7 e outro de
10,3. Ao pH do plasma norma, o ácido úrico se encontra na forma de
uratos, com o grupo hidroxila da posição 8 ionizado. As solubilidades
são 0,38 mmol/l (64,5 mg/l) para o ácido úrico e 5,8 mmol/l (1103 mg/l)
para o urato monossódico. Os cristais de urato encontrados nos fluidos
articulares, com freqüência são formados por urato monossódico, embora
os obtidos de litíases renais sejam compostos geralmente por ácido
úrico.
O urato é sintetizado pelo organismo e também pode ser obtido a partir
da dieta. Os mecanismos renais eliminam 75%, e os 25% restantes são
excretados pelo intestino. Os uratos são filtrados pelo glomérulo e
cerca de 98% são reabsorvidos pelos túbulos proximais. Cerca de 8% da
quantidade de urato filtrada são excretados pela urina. Uma fração dos
uratos reabsorvidos é excretada finalmente por meio de um mecanismo
secretor. Assim, a maior parte dos 8% da quantidade original filtrada
pelo rim, é excretada por meio de transporte ativo.
A hiperuricemia é uma herança familiar e em 25% dos indivíduos deve-se a
um aumento na síntese das purinas. Em outros indivíduos, a hiperuricemia
pode ser resultado de uma diminuição da capacidade renal para secretar
uratos, o que pode provocar a formação de cristais de urato em
articulações, causando a inflamação ou gota.
A distribuição dos valores de ácido úrico sérico para 940 homens que não
sofriam de gota e para 60 homens com gota, mostrou que um homem adulto
normal tem uma concentração de 51 ± 9,3 mg/l (303 ± 55,3 mmol/l) medida
através de um procedimento enzimático. Apenas 5% dos homens normais
tinham valores de urato sérico superiores a 70 mg/l, enquanto apenas 9%
dos pacientes gotosos apresentavam níveis inferiores a este valor. Os
pacientes com gota tiveram concentrações séricas de ácido úrico entre 58
e 150 mg/l, com um valor médio de 98 mg/l.
No estudo da população de Framingham, a maior incidência de gota
articular em homens hiperuricêmicos foi observada naqueles com maior
concentração de ácido úrico. Dezenove por cento dos homens estudados que
tinham valor entre 80 e 89 mg/l desenvolveram gota. Cinco de seis
pacientes com valores superiores a 90 mg/l apresentaram gota.
Urina
A relação de ácido úrico e creatinina em amostras de urina tomadas pela
manhã tem sido empregada como prova discriminatória para a detecção da
síndrome de Lesch-Nyhan, que está associada a ausência quase completa de
atividade da enzima hipoxantina-guanina fosforribosiltransferase. Esta
relação tem sido aplicada a amostras de urinas de 24 horas de pacientes
adultos com gota, para detectar a deficiência parcial da referida
enzima. A relação ácido úrico-creatinina dos pacientes normais oscila
entre 0,21 e 0,59. Os pacientes com gota apresentam valores de 0,15 a
0,73, enquanto aqueles pacientes com hiperuricemia associada a outra
desordem, como uma leucemia ou enfermidade por depósito de glucogênio,
têm uma relação de 0,25 a 1,77. Para pacientes com artrite não-gotosa, a
relação é de 0,27 a 0,58. Os indivíduos com uma deficiência total de
hioxantina-guanina fosforribosiltransferase têm uma relação ácido
úrico-creatinina na urina entre 1,98 a 5,35, enquanto os pacientes com
gota acompanhada por uma deficiência parcial da enzima este valor oscila
entre 0,62 a 2,00.
Tem-se observado que a relação ácido úrico-creatinina em uma amostra de
urina tomada ao acaso, é maior que 1,00 em pacientes com insuficiência
renal aguda secundária a uma nefropatia aguda por ácido úrico, e menor
que 1,00 em pacientes com insuficiência renal aguda devida a outras
causas.
Líquido sinovial
Em numerosas oportunidades tem-se intentado usar os níveis de ácido
úrico no líquido sinovial para indicador de gota. Weinberger e col.
demonstraram uma correlação positiva entre os níveis séricos e de
líquido de uratos em pacientes sem artropatia.
Em outro estudo examinou-se 28 amostras de líquidos sinoviais em busca
de cristais de urato; ademais, a comparação das concentrações de ácido
úrico em soro e líquido sinovial revelou que neste último o nível de
ácido úrico era significativamente maior que o nível sérico em quatro de
oito pacientes com gota. Em três destes pacientes isto se devia aos
cristais de urato observados no líquido sinovial. na maioria dos casos o
nível de ácido úrico no líquido sinovial era pouco mais baixo do que
achado no soro.
Em um terceiro estudo, encontrou-se que as concentrações de ácido úrico
em líquido sinovial eram semelhantes às de soro. A concentração média no
líquido sinovial, empregando um método enzimático era 74,3 mg/l, para 37
amostras, enquanto que o valor médio para a concentração sérica obtida
simultaneamente foi 76,9 mg/l. Os valores mais recentes oscilam entre 25
e 72 mg/l. Esta informação aparentemente não tem valor clínico e não é
solicitada com freqüência.
Xantina
Tem-se observado que a presença de xantina diminui falsamente os valores
obtidos para ácido úrico pelo método da uricase. Aparentemente a xantina
atua como um inibidor competitivo da uricase. O método de referência
proposto para ácido úrico no soro emprega um método de uricase com
buffer Tris que apresenta um desvio percentual médio de -9,1, com
relação a um valor teórico de 0,30 mmol/l, quando a xantina se encontra
em concentração de 100 mg/l.
A história de um caso com hiperxantinemia causada pela terapia com
alopurinol demonstrou que a presença de níveis de xantina superiores a
50 mg/l leva a valores baixos errôneos de ácido úrico sérico medidos por
um método com uricase. À medida que a concentração de xantina sérica
aumentava de 12,5 mg/l à 200 mg/l, a concentração aparente de ácido
úrico medido por um método enzimático diminuia de 51 a 26 mg/l, porém
não variava se fosse empregado um procedimento com fototungstato. A
discrepância dos valores de ácido úrico correspondia às concentrações
séricas de xantina. Os valores falsos baixos de ácido úrico são pouco
comuns, visto que a concentração de xantina raramente é superior a 50
mg/l. Sem dúvida, esta possibilidade deve ser levada em conta quando se
empregam métodos com uricase.
Outro informe sugere que o efeito inibidor da xantina pode ser superado
se for aumentada a quantidade de uricase presente no reativo de
trabalho.
Notas
O ácido úrico se encontra na urina na forma de uratos monossódicos,
dissódicos e em proporção escassa de ácido úrico livre. O ácido úrico
eliminado tem dupla origem: exógeno que provém do aporte alimentício de
compostos púricos, e no endógeno provém do catabolismo das
nucleoproteínas celulares. A quantidade de ácido úrico excretada é maior
em crianças que em adultos.
O controle do metabolismo do ácido úrico é uma parte esssncial da
terapia da leucemia mielógena crônica. A produção de ácido úrico aumenta
em pacientes com células leucêmicas em crescimento rápido ou muito
numerosas. A rápida lise celular em casos de crises blásticas pode
causar um considerável aumento do ácido úrico sérico, que leva a uma
nefropatia aguda por uratos, a qual, se não tratada, pode causar uma
azoemia com insuficiência renal. Em conseqüência, é necessário verificar
periodicamente os níveis séricos de ácido úrico, nitrogênio de uréia e
creatinina.